Autora: Maria Júlia Souto (cardiologista e especialista em imagem cardiovascular pelo Instituto Dante Pazzanese de Cardiologia)
Em 2022 fui pela primeira vez ao congresso da ESC, na ocasião em Barcelona. “Tabaroa” que sou, tudo me impressionava rs. Mas um fato chamou minha atenção mais que os outros:
Estavam realizando testes para dosagem da lipoproteína(a) (Lp(a)) ali mesmo, no meio do congresso! Tenho provas:
Desde então isso não sai da minha cabeça: “será que devemos mesmo fazer o rastreio de Lp(a)? Se sim, por que? Já temos tratamentos direcionados ou evidências suficientes para mudar a nossa conduta?”.
Hoje, temos diversas evidências que nos ajudam a responder esses dois questionamentos.
🎯 E esse é o objetivo dessa Prime. Com base em diversos estudos, em especial na última revisão publicada no The Lancet esse ano, nós iremos:
Revisitar a Lp(a) e entender porque ela é mais perigosa até que o tradicional LDL.
Explorar sua origem genética.
Avaliar para quem devemos solicitar o exame.
Discutir como manejar o paciente com Lp(a) elevada.
Apresentar os novos tratamentos que prometem revolucionar a cardiologia.
🎙️ Ainda vou deixar uma dica extra: no episódio 41 do DozeCast, lá em julho de 2022, nós já discutíamos o tema da Lp(a) (vanguarda da cardiologia que chama, né queridos?! rs).
Recomendo fortemente que você aproveite para escutá-lo e já comparar as mudanças nesses últimos 3 anos.
O que é a Lp(a)?
Nossa primeira missão é que você entenda a diferença da Lp(a) para o LDL, nosso velho conhecido (e inimigo mortal).
Já saiba que a Lp(a) é ainda mais traiçoeira que o LDL, uma vez que não conseguimos controlá-la apenas com dieta, exercício e estatina.
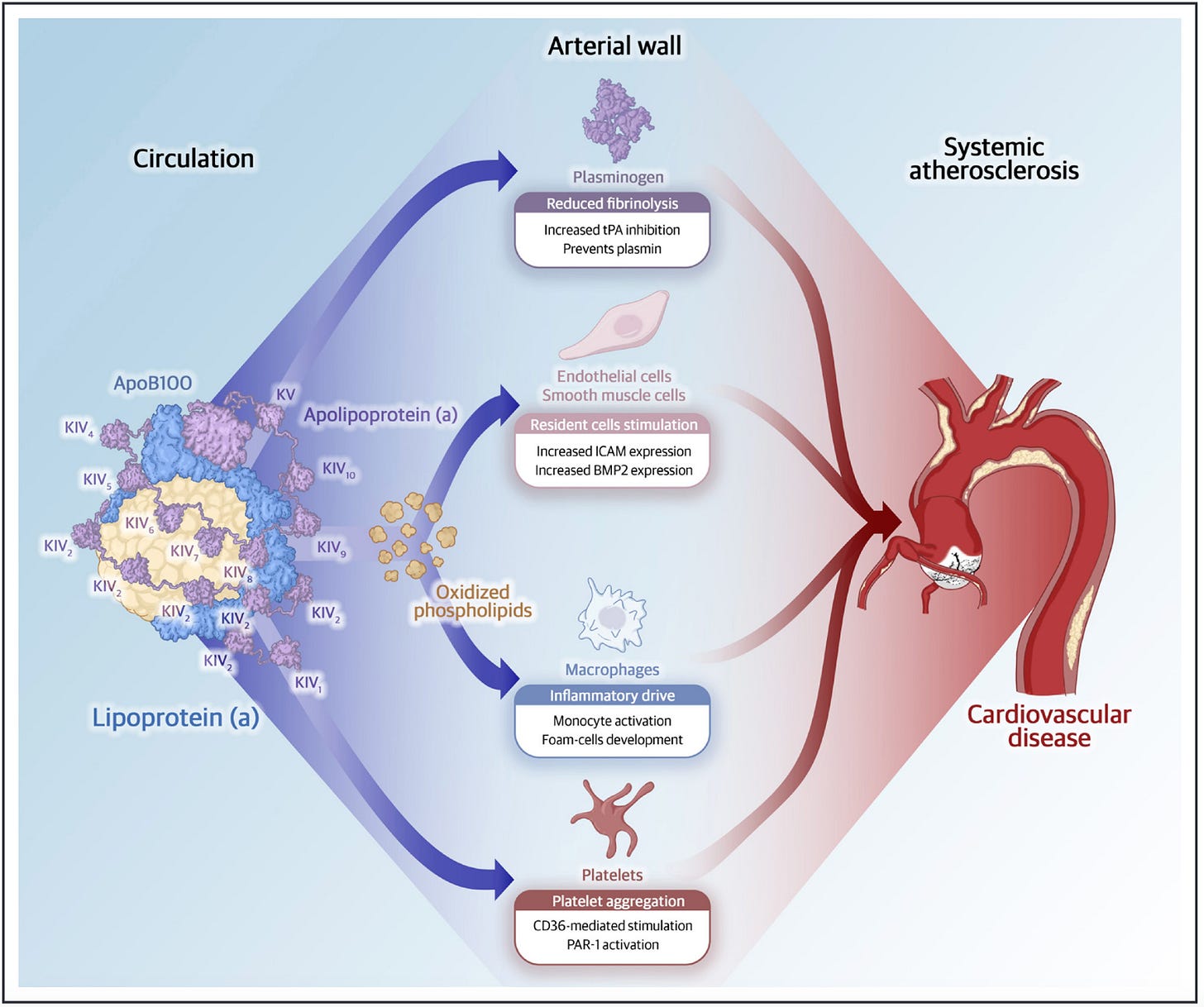
Assim como o LDL, a Lp(a) carrega colesterol e apolipoproteína B. A diferença é que ela vem acoplada a uma molécula extra chamada apolipoproteína(a), ligada ao LDL por uma ponte de enxofre. Essa caroninha muda tudo: a Lp(a) se comporta como um colesterol com armadura trombogênica.
Essa tendência trombofílica da apolipoproteína(a) vem do fato que ela se parece com uma versão distorcida do plasminogênio (responsável pela dissolução de coágulos), mas sem a capacidade de promover fibrinólise.
Resultado? A Lp(a) se liga à fibrina e atrapalha a quebra dos trombos, favorecendo a formação de coágulos nos locais errados (nas placas instáveis, talvez?).
Ela também leva colesterol direto para o foco da lesão, alimentando a inflamação e o crescimento da placa aterosclerótica.
De onde ela vem?
A Lp(a) é quase toda determinada geneticamente. Ou seja, mais de 90% da sua concentração vem do DNA, com destaque para o número de repetições do kringle IV tipo 2 (uma estrutura parecida com pretzel, e daí que vem o nome), que define o tamanho da apolipoproteína(a).
E esse número varia MUITO: algumas pessoas têm poucas cópias (e muita Lp(a)), outras têm mais de 40 (e menos Lp(a)). Não dá pra prever pelo perfil lipídico padrão.
Bom, e assim surge um dos principais vilões silenciosos da cardiologia moderna.
🫠 Fun fact:
Essa estrutura surgiu na evolução a partir do gene do plasminogênio, então acredita-se que conferia vantagens evolutivas, como melhor cicatrização de feridas e sobrevida no parto, especialmente em épocas sem medicina moderna.
Mas… para aqueles que sobrevivem além dos 50 anos ela passa a ser um problema: começa a se acumular em locais de lesão endotelial, inibe a quebra de trombos e favorece o crescimento de coágulos e placas ateroscleróticas.
Ou seja: boa pra sobrevivência na infância, perigosa pra longevidade.
Epidemiologia
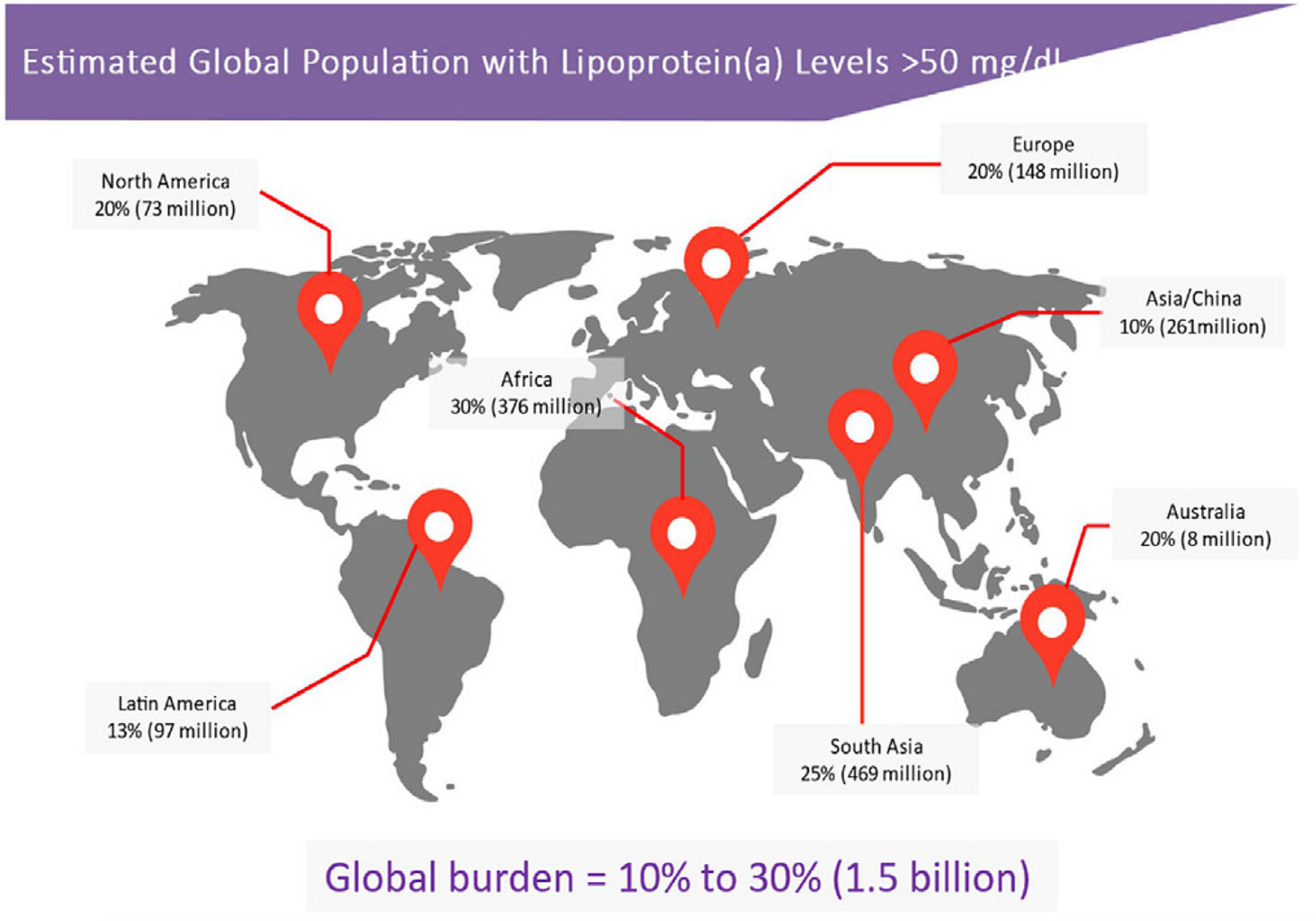
A Lp(a) elevada é mais comum do que você imagina: estima-se que 1 em cada 5 adultos no mundo tenha níveis elevados de Lp(a), acima de 50 mg/dL.
Isso representa mais de 1 bilhão de pessoas com um fator de risco cardiovascular silencioso.
A distribuição é totalmente genética e populacional:
Afrodescendentes tendem a ter níveis médios mais altos — mas com menor variabilidade individual.
Europeus, latinos e asiáticos apresentam grande variabilidade, com níveis que vão de quase zero até mais de 200 mg/dL.
Nos EUA, por exemplo, cerca de 15% dos brancos e 35% dos negros têm Lp(a) ≥125 nmol/L (o que equivale a aproximadamente 50 mg/dL). No Brasil, os dados são mais escassos, mas provavelmente seguimos o padrão de grande heterogeneidade.
Como dosar a Lp(a)?
Uma vez que os níveis da Lp(a) são geneticamente determinados e comumente estáveis ao longo da vida, a dosagem só precisa ser feita uma vez (que tal junto ao primeiro pedido de lipidograma do seu paciente?).
No entanto, eu preciso que você fique atento a alguns detalhes na hora de pedir e interpretá-lo:
A unidade importa:
A unidade expressa em nmol/L mede o número de partículas, enquanto o mg/dL mede a massa total da partícula (inclui o colesterol + apo(a)). Assim, o primeiro é teoricamente mais fidedigno (não significa que você deve descartar dosagens em mg/dL!) e a sua conversão de uma unidade para a outra é meio difícil.
O artigo do The Lancet até propõe uma fórmula aproximada: Lp(a) (nmol/L) = 2,18 × Lp(a) (mg/dL) – 3,83.
Qual o ponto de corte?
O risco cardiovascular aumenta gradualmente com o aumento da Lp(a), então não há bem um ponto de corte.
No entanto, sabe-se que pacientes com Lp(a) > 30 mg/dL (ou 62 nmol/L) já têm um risco um pouco aumentado, sendo muito pior quando Lp(a) ≥ 50 mg/dL (105 nmol/L) que é o ponto mais considerado.
Além disso, valores ≥90 mg/dL (190 nmol/L) associam-se a risco ainda mais alto; e aqueles com Lp(a) > 130 mg/dL (280 nmol/L) têm altíssimo risco, comparável ao da hipercolesterolemia familiar.
Mulheres que dosaram antes da menopausa devem repetir 5 anos após o climatério
Após IAM ou AVC, dosar na admissão e repetir em 1–3 meses com o objetivo de evitar distorções da fase aguda.
A Lp(a) e o risco cardiovascular
Hoje já existe evidência genética robusta de que níveis elevados de Lp(a) causam doença cardiovascular, e não apenas estão associados a ela. Isso foi possível graças a estudos de randomização mendeliana, que eliminam os vícios clássicos dos estudos observacionais, como confundimento e causalidade reversa.
O fato de que mais de 90% da Lp(a) é determinada geneticamente nos permite dizer que ela é, de longe, uma das variantes genéticas mais impactantes no risco de DAC já descritas.
Pessoas com variantes que elevam a Lp(a) têm risco aumentado de infarto, estenose aórtica, AVC isquêmico, insuficiência cardíaca, doença arterial periférica e até mortalidade global. Como já dissemos: quanto maior o nível, maior o risco.
Em termos populacionais, o impacto é imenso:
Pessoas no topo dos 5% da Lp(a) (>90 mg/dL ou >190 nmol/L) têm até 3 vezes mais risco de infarto e estenose aórtica.
Para eventos como AVC e mortalidade cardiovascular, o risco gira entre 1,2 e 1,6 vezes maior.
E esse risco é independente de LDL, PCR ou uso de estatina.
Se fôssemos fazer uma escala absoluta de eventos adicionais por 10.000 pessoas-ano entre indivíduos com concentrações altas versus baixas de Lp(a), o infarto do miocárdio é o evento mais relevante, seguido por estenose da valva aórtica, insuficiência cardíaca e AVCi.
E tem mais: quem já teve um evento cardiovascular também está em risco aumentado de recorrência se tiver Lp(a) alta — mesmo controlando os outros fatores de risco.
Em pacientes com hipercolesterolemia familiar (HF), a Lp(a) entra como um agravante: cerca de 1 em cada 4 pacientes com HF têm Lp(a) elevada, o que piora o prognóstico e exige ainda mais rigor no controle do risco residual.
O que podemos concluir é que a Lp(a) não é coadjuvante. É altamente prevalente e atua desde a infância, nos permitindo identificar paciente que exigem ainda mais a nossa atenção, mesmo se “de baixo risco” segundo os escores tradicionais.
👀 Olho no detalhe:
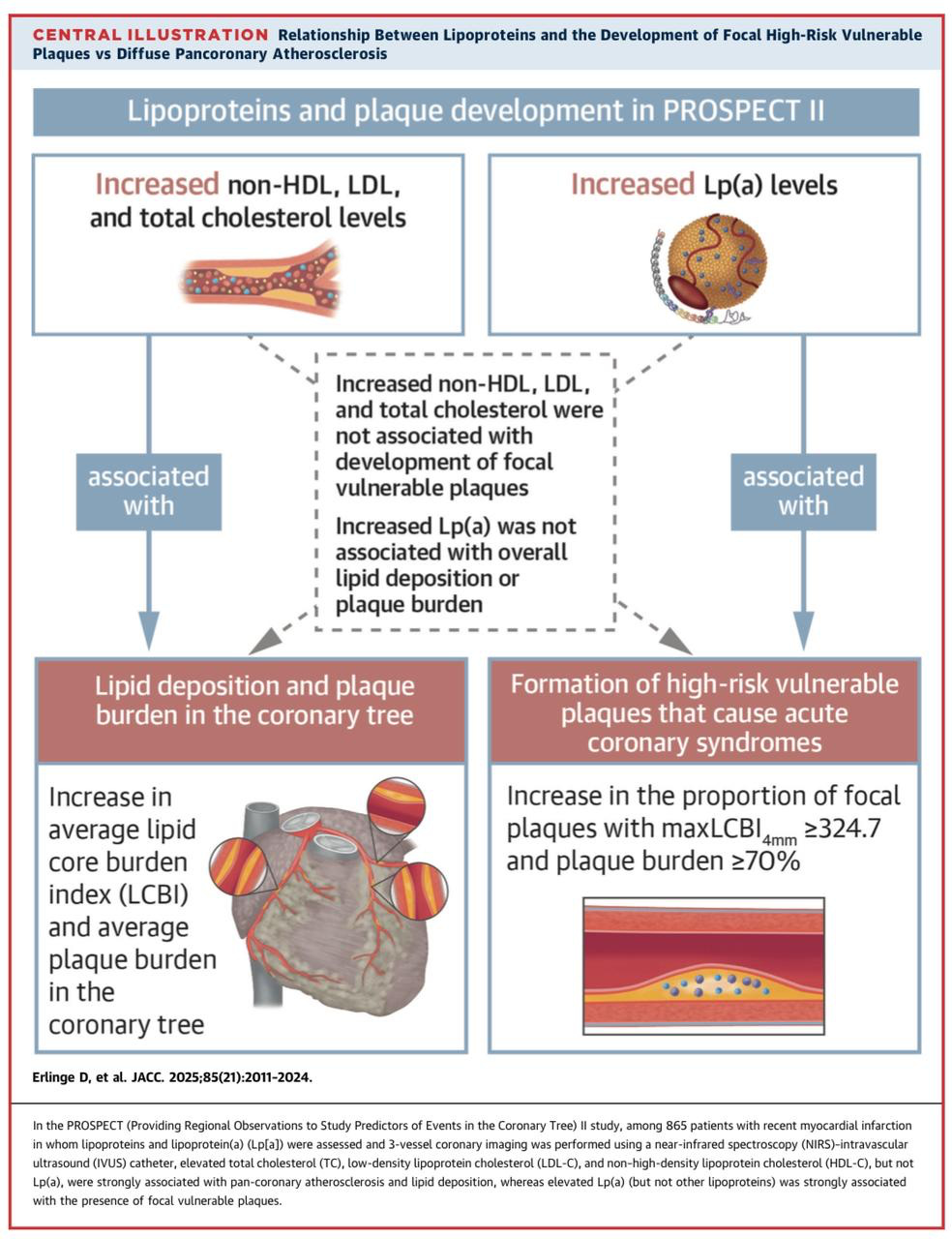
Uma subanálise quentinha 🔥 do estudo PROSPECT II, publicada na semana passada, que avaliou 865 pacientes com IAM recente passaram por uma avaliação completa das 3 artérias coronárias com IVUS e NIRS, observou que a Lp(a) associou-se à presença de placas focalmente vulneráveis (aquelas com maior risco de ruptura, mesmo sem obstrução significativa!).
O que recomendam as diretrizes?
Tanto diretrizes de prevenção cardiovascular da Europa, Reino Unido, França, Polônia, Canadá, EUA, Índia e China quanto consensos internacionais recomendam:
dosar Lp(a) pelo menos uma vez na vida em qualquer pessoa com risco cardiovascular;
ou focar nos grupos de maior risco, como:
História pessoal ou familiar de DAC precoce;
Hipercolesterolemia familiar;
Risco cardiovascular moderado a alto;
Parentes com Lp(a) elevada;
Estenose aórtica calcificada;
Pacientes com LDL persistentemente elevado apesar de estatinas (resistência ao tratamento).
A reclassificação do risco de doença cardiovascular aterosclerótica só deve ser considerada quando as concentrações de Lp(a) estiverem elevadas, por exemplo, levando em conta tanto a Lp(a) quanto o risco absoluto basal de DAC.
Em outras palavras, como a Lp(a) tem um padrão de piora progressiva do risco cardiovascular, ela só é capaz de reclassificar o paciente para cima, ou seja, naqueles com alto risco.
Não é como o escore de cálcio, por exemplo, que quando 0 pode reduzir a classificação de risco.
Como manejar
Talvez desde o início dessa Prime você esteja pensando: “do que me serve dosar um lipídio que eu não tenho tratamento específico?”.
Enquanto ainda não temos uma terapia eficaz e aprovada para reduzir a Lp(a), seu valor clínico está justamente em refinar o risco cardiovascular do paciente.
Saber que ele tem uma Lp(a) elevada pode mudar sua conduta: você passa a tratar esse paciente como de risco mais alto, mesmo que o LDL esteja “ok” ou a inflamação esteja controlada.
Na prática, o manejo foca em atacar com força os fatores de risco modificáveis. Cessar o tabagismo, controlar a pressão arterial, o diabetes, o excesso de peso e estimular a prática de atividade física são pilares inegociáveis. Mas o destaque mesmo vai para a redução agressiva do LDL — porque é justamente a combinação de Lp(a) alta com LDL elevado que mais promove eventos cardiovasculares.
E aí entram as armas conhecidas: estatinas de alta potência, ezetimibe e, principalmente, os inibidores de PCSK9 — que além de reduzir o LDL em até 60%, ainda baixam a Lp(a) em cerca de 25%. Para pacientes em prevenção secundária com Lp(a) muito alta, os dados mais recentes sugerem que o benefício dos PCSK9 pode ser ainda maior.
Terapias mais específicas, como a aférese, conseguem reduzir a Lp(a) em até 70%, mas ainda são caras, invasivas e restritas a poucos centros — sendo usadas, por enquanto, apenas em casos extremos, como pacientes com eventos recorrentes e Lp(a) persistentemente acima de 60 mg/dL.
Já a niacina até reduz Lp(a), mas caiu em desuso pelos efeitos adversos e falta de benefício clínico comprovado.
⚠️ Atenção!
Apesar do risco trombótico associado à Lp(a), não há recomendação atual para uso de AAS em prevenção primária só por conta disso. Se o paciente já tem DAC estabelecida, tudo bem, mas fora disso, o risco pode superar o benefício.
Enquanto os novos tratamentos não chegam, o segredo está em fazer o básico com excelência, ajustando a intensidade do tratamento ao novo patamar de risco que a Lp(a) revelou.
O que vem por aí?
A era dos tratamentos específicos para Lp(a) finalmente está batendo à porta.
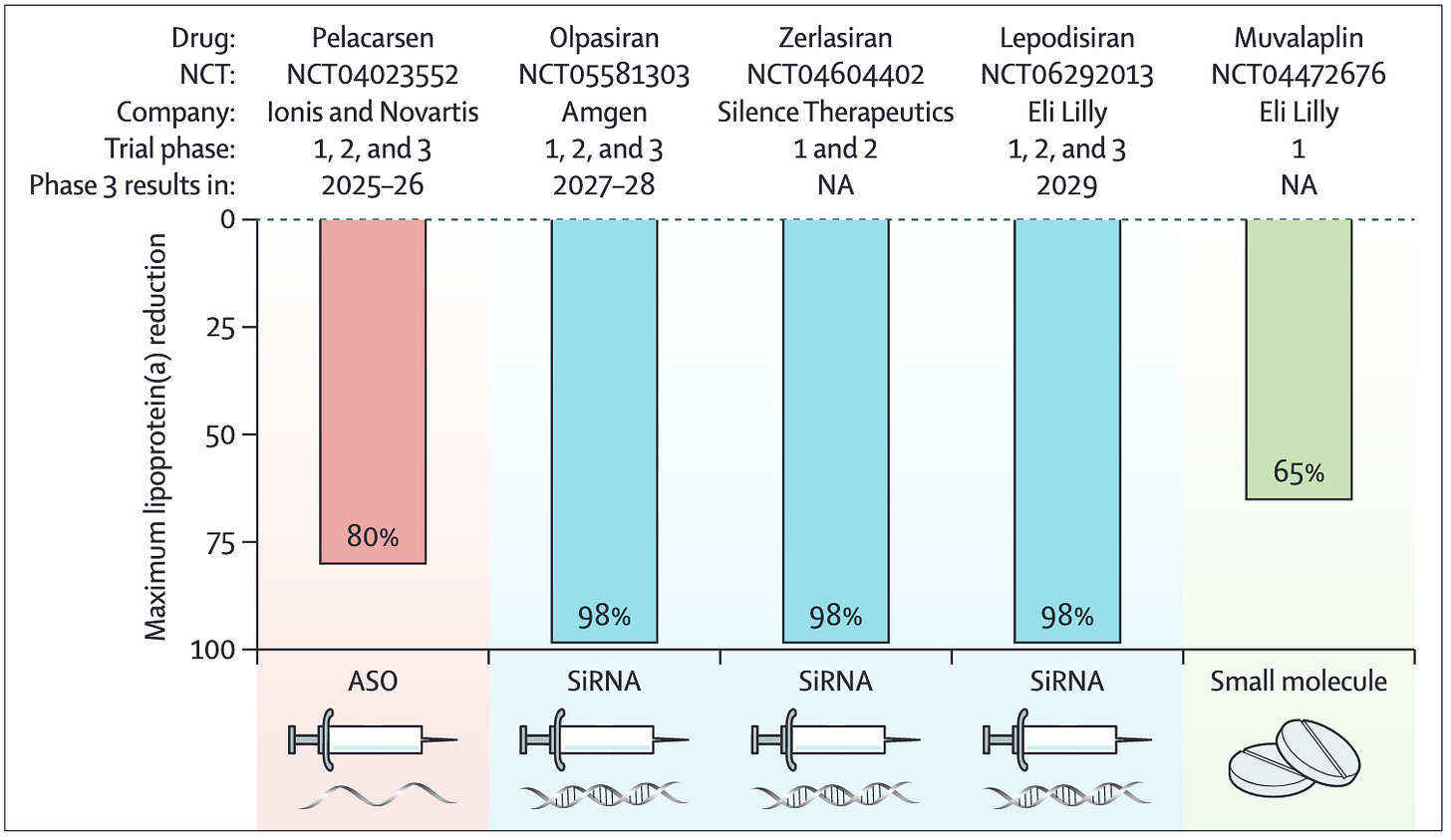
Pelo menos cinco drogas estão em desenvolvimento clínico avançado com um objetivo claro: silenciar o gene da apolipoproteína(a) ou impedir sua ligação ao LDL. Os resultados até agora são animadores — com reduções de Lp(a) que variam de 65% a impressionantes 98%.
Entre os candidatos mais promissores:
Pelacarsen, com injeção mensal, já está em fase 3 e deve ter resultados entre 2025–2026.
Olpasiran e Lepodisiran, que usam tecnologia de RNA interferente (siRNA), têm administração subcutânea de 2 a 4 vezes ao ano e estão sendo testados em estudos robustos com milhares de pacientes.
Muvalaplin é uma opção oral diária, ainda em fases iniciais.
Esses estudos (como o Lp(a)HORIZON, OCEAN(a) e ACCLAIM-Lp(a)) estão incluindo pacientes com doença aterosclerótica estabelecida e Lp(a) elevada, avaliando desfechos duros como infarto, AVC, morte cardiovascular e revascularização urgente.
Além disso, PCSK9 orais, inibidores de CETP e até edição genética também estão sendo investigados para modular a Lp(a) — embora ainda sem testes que comprovem redução de eventos cardiovasculares.
O cenário está prestes a mudar. Pela primeira vez, temos uma linha de desenvolvimento terapêutico robusta, específica e potencialmente transformadora para lidar com essa partícula que por tanto tempo ficou relegada ao rodapé dos laudos de lipidograma.